26.04.24
Das Periodensystem der Elemente
Was ist das Periodensystem?
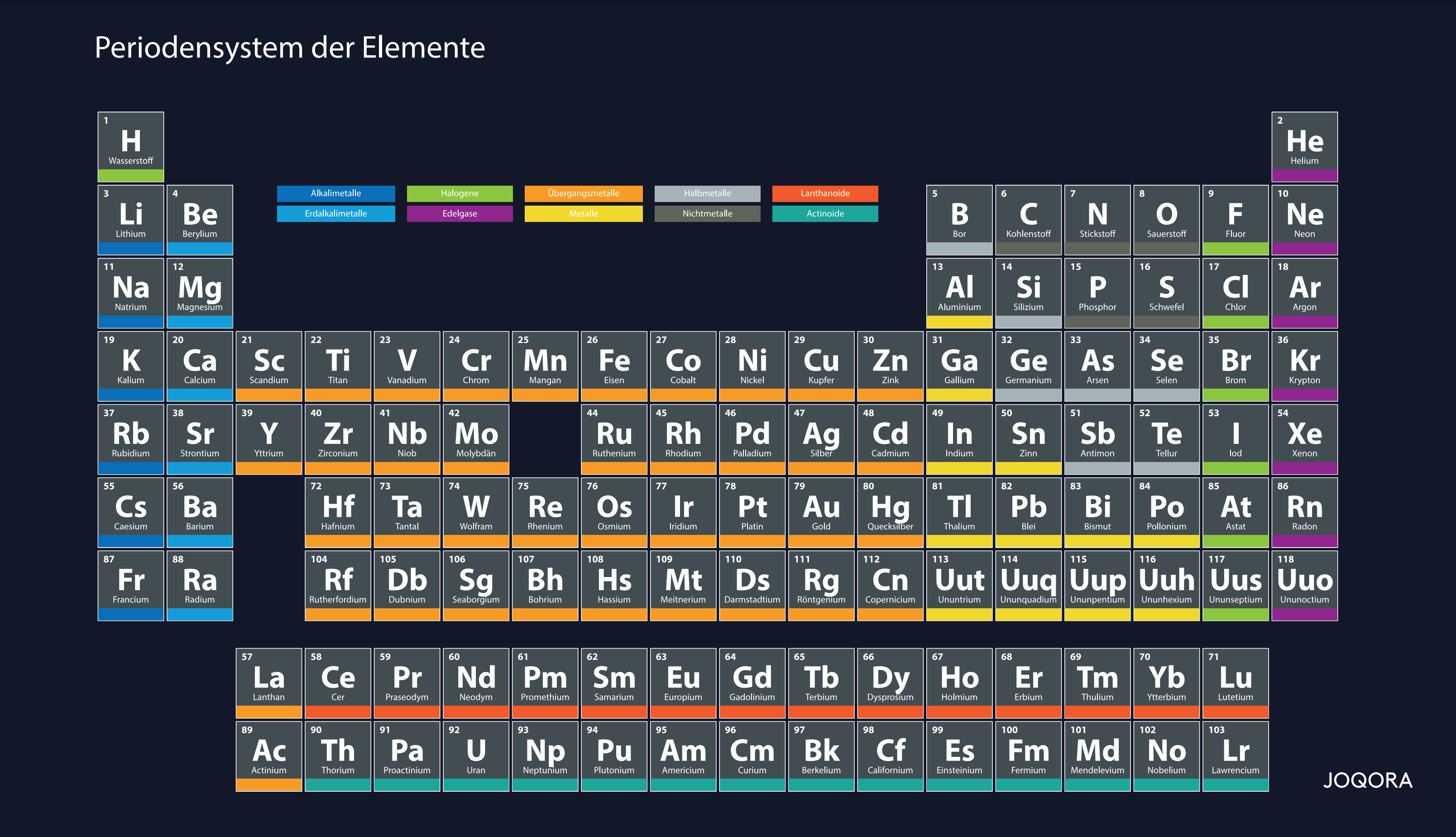
Das PSE ist eine tabellarische Übersicht, in der alle chemischen Elemente eingeordnet werden. Dabei zeigen die sieben Zeilen (Perioden) die Atomschalen (Schalenmodell) auf, deren Anzahl sich von oben nach unten um jeweils eine Schale erhöht. Die Spalten stellen Gruppen von chemischen Elementen dar, welche sich durch ähnliche Eigenschaften auszeichnen. Die Elemente an sich sind über die jeweiligen Elementsymbole in der Tabelle zu lokalisieren.
Möchten Sie eine detaillierte visuelle Darstellung des Periodensystems sehen? Laden Sie hier unser Periodensystem PDF herunter
Das PSE wird in den Perioden (Zeilen) über die Ordnungszahl sortiert. Diese gibt die Anzahl der Elektronen und Protonen eines jeden Elements an. Helium (He) hat demnach die Ordnungszahl zwei und besitzt zwei Elektronen und zwei Protonen. Die Ordnungszahl steigt von rechts nach links immer um den Faktor 1 an. Das nächstfolgende Element Lithium hat demnach drei Elektronen und drei Protonen. Diese passen nicht mehr auf die eine Schale. Deshalb kann festgestellt werden, dass Lithium zwei Schalen besitzt. Diese Systematik wird so lange fortgeführt, bis das letzte Element Oganesson (Og) erreicht ist, welches aus sieben Schalen besteht, auf denen sich dessen 118 Elektronen und 118 Protonen anordnen.
Die 18 Gruppen (Spalten) des PSE sind aufgeteilt in zehn Hauptgruppen und acht Nebengruppen. Die Elemente einer Gruppe weisen ähnliche Eigenschaften auf. Sie zeigen in einer chemischen Reaktion ein vergleichbares Verhalten. So reagieren beispielsweise die Elemente Lithium (Li), Natrium (Na) und Kalium (K) als Elemente der sogenannten Gruppe der Alkalimetalle sehr stark auf Wasser.
Häufig gestellte Fragen zum Periodensystem
Was versteht man unter der Ordnungszahl im Periodensystem?
Die Ordnungszahl im Periodensystem gibt die Anzahl der Protonen in einem Atomkern an und ist gleichzeitig auch die Anzahl der Elektronen in einem neutralen Atom. Sie bestimmt die eindeutige Identifikation eines Elements und seine Position im Periodensystem.
Wie viele Perioden gibt es im Periodensystem?
Im Periodensystem gibt es sieben Perioden, die jeweils eine horizontale Reihe von Elementen darstellen. Jede Periode entspricht der Anzahl der Elektronenschalen eines Atoms in dieser Reihe.
Für eine tiefergehende Betrachtung weiterer spannender Aspekte des Periodensystems, einschließlich seltener Elemente und ihrer Anwendungen, betrachten wir einige fortgeschrittene chemische Eigenschaften, die die Einzigartigkeit und Vielseitigkeit der Elemente im PSE zeigen:
- Transaktinoide: Diese seltenen und schwer herstellbaren Elemente umfassen die Elemente mit Ordnungszahlen über 103. Ihre chemischen Eigenschaften sind nur wenig erforscht, da sie extrem instabil sind und eine sehr kurze Halbwertszeit haben.
- Lanthanoide und Actinoide: Bekannt für ihre magnetischen und leuchtenden Eigenschaften, werden diese Elemente in modernen Technologien wie der Herstellung von starken Magneten und in Leuchtmitteln verwendet.
- Superhalogene: Dies sind Moleküle, deren Ionisierungsenergien die der Halogene übertreffen. Sie könnten potenziell für die Entwicklung neuer Materialien mit speziellen elektronischen Eigenschaften eingesetzt werden.
- Elektronenaffinität: Einige Elemente, wie die Halogene, weisen eine hohe Elektronenaffinität auf, was sie zu hervorragenden Oxidationsmitteln macht. Diese Eigenschaft ist entscheidend für viele chemische Reaktionen, insbesondere in der organischen Chemie und der Synthese.
Diese fortgeschrittenen Aspekte des Periodensystems zeigen, wie tief und breit das Feld der Chemie wirklich ist und wie es sich ständig weiterentwickelt, um neue wissenschaftliche und technologische Herausforderungen zu meistern.
Der Aufbau des Periodensystems
Das Periodensystem der Elemente ist systematisch in Perioden und Gruppen gegliedert. Die sieben Perioden werden horizontal angeordnet, während die acht Hauptgruppen vertikal ausgerichtet sind. Zwischen der zweiten und dritten Hauptgruppe befinden sich zehn Nebengruppen. Hier betrachten wir die wichtigsten Begriffe des Periodensystems etwas genauer.
| Periode (Horizontal) | Anzahl der Elemente | Beispiele |
|---|---|---|
| 1. Periode | 2 Elemente | Wasserstoff (H), Helium (He) |
| 2. Periode | 8 Elemente | Lithium (Li) bis Neon (Ne) |
| 3. Periode | 8 Elemente | Natrium (Na) bis Argon (Ar) |
| 4. Periode | 18 Elemente | Kalium (K) bis Krypton (Kr) |
| 5. Periode | 18 Elemente | Rubidium (Rb) bis Xenon (Xe) |
| 6. Periode | 32 Elemente | Zäsium (Cs) bis Radon (Rn) |
| 7. Periode | 32 Elemente | Francium (Fr) bis Oganesson (Og) |
Perioden
Die Zeilen im PSE, bekannt als Perioden, werden von oben nach unten nummeriert und stehen in direktem Zusammenhang mit dem Aufbau der Atome im Schalenmodell. Das Schalenmodell wird oft mit einer Zwiebel verglichen, wobei sich die Schalen um einen Mittelpunkt, den Atomkern, anordnen. Die Anzahl der Schalen eines Elements ist abhängig von der Anzahl der Elektronen, da jede Schale nur eine bestimmte Menge von Elektronen aufnehmen kann.
Ordnungszahl
Die Ordnungszahl ist entscheidend für die Positionierung der Elemente im Periodensystem und gibt die Anzahl der Protonen und Elektronen in einem Atom an. Sie bestimmt, wie viele Elektronen ein Element in seinen Schalen hat, was wiederum wesentliche Eigenschaften wie die chemische Reaktivität und das Bindungsverhalten beeinflusst.
Verteilung der Elektronen
Die Elektronenverteilung im Periodensystem folgt klaren Regeln: Die erste Periode endet mit dem Element Helium, das nur zwei Elektronen in seiner einzigen Schale hat. Jede weitere Periode fügt Schalen hinzu und erhöht so die Kapazität für Elektronen, was sich in der zunehmenden Elementanzahl zeigt.
Gruppen
Die Spalten des PSE werden als Gruppen bezeichnet. Diese sind in Haupt- und Nebengruppen unterteilt, wobei jedes Element einer Gruppe ähnliche chemische Eigenschaften aufweist. Die Alkalimetalle wie Lithium, Natrium und Kalium sind Beispiele für Elemente einer Gruppe, die in chemischen Reaktionen besonders reaktiv sind.
Elementkarte
Jedes Element im PSE wird durch eine Elementkarte dargestellt, die wichtige Informationen wie Ordnungszahl, Elementsymbol, Aggregatzustand und Elektronegativität enthält. Diese Karten sind entscheidend, um die Eigenschaften und das Verhalten der Elemente schnell zu verstehen.
Besonderheiten im Periodensystem
Chemische Elemente weisen innerhalb des Periodensystems bestimmte Trends auf, die sich in den physikalischen und chemischen Eigenschaften manifestieren. Diese Trends helfen Wissenschaftlern und Studenten, das Verhalten der Elemente besser zu verstehen und vorherzusagen.
Elektronegativität
Die Elektronegativität eines Elements beschreibt seine Fähigkeit, Elektronen in einer chemischen Bindung anzuziehen. Innerhalb einer Periode nimmt die Elektronegativität von links nach rechts zu, da die Anzahl der Protonen im Kern steigt, was eine stärkere Anziehung auf die Valenzelektronen ausübt. In den Gruppen nimmt sie von oben nach unten ab, da die zunehmende Anzahl von Elektronenschalen die Kernanziehungskraft auf weiter entfernte Valenzelektronen schwächt.
Ionisierungsenergie
Die Ionisierungsenergie ist die Energie, die benötigt wird, um das am schwächsten gebundene Elektron von einem neutralen Atom zu entfernen. Sie nimmt ebenfalls innerhalb einer Periode von links nach rechts zu, da die Elektronen fester gebunden sind, weil die Kernladung wächst. Innerhalb der Gruppen nimmt die Ionisierungsenergie von oben nach unten ab, da die äußeren Elektronen weiter vom Kern entfernt sind und weniger stark angezogen werden.
Atomradius
Der Atomradius beschreibt die Größe eines Atoms und variiert signifikant über das Periodensystem. Innerhalb der Perioden nimmt der Atomradius von links nach rechts ab, weil die zunehmende positive Ladung im Kern die Elektronenschalen stärker anzieht und näher zusammenzieht. In den Gruppen nimmt der Radius von oben nach unten zu, da mit jeder Periode eine neue Schale hinzukommt und die äußeren Schalen weiter vom Kern entfernt sind.
Geschichte des Periodensystems
Die Entwicklung des Periodensystems ist ein Meilenstein der Wissenschaftsgeschichte, der eng mit den Namen Johann Döbereiner, Dmitri Mendelejew und Lothar Meyer verbunden ist. Diese Wissenschaftler haben durch ihre Beobachtungen und theoretischen Arbeiten die Grundlage für das moderne Periodensystem gelegt.
Johann Döbereiner
Johann Döbereiner (1780-1849) war ein deutscher Chemiker, der die sogenannten Triaden entdeckte, Gruppen von drei Elementen mit ähnlichen chemischen Eigenschaften, deren Atomgewichte ein klares Muster zeigten. Diese Entdeckung führte zu den ersten Anfängen der Periodizität in der Chemie.
Dmitri Iwanowitsch Mendelejew
Dmitri Mendelejew (1834-1907), ein russischer Chemiker, entwickelte das erste umfassende Periodensystem der Elemente, das aufgrund seiner Vorhersagen für bis dahin unbekannte Elemente und ihrer Eigenschaften berühmt wurde. Sein Periodensystem wurde schließlich weltweit anerkannt und ist die Basis des heutigen Systems.
Lothar Meyer
Lothar Meyer (1830-1895), ein deutscher Chemiker, arbeitete unabhängig von Mendelejew an einer ähnlichen Anordnung. Obwohl Mendelejew oft mehr Anerkennung erhält, trug Meyers Arbeit wesentlich zur Entwicklung und Akzeptanz des Periodensystems bei.
Heute umfasst das Periodensystem 118 bestätigte Elemente, und Forschungen an neuen Elementen sowie deren Eigenschaften werden stetig fortgeführt. Das Periodensystem bleibt ein dynamisches Feld in der Chemie, das sowohl Grundlagenforschung als auch angewandte Wissenschaften bereichert.
Zusammenfassung des Periodensystems
Diese Zusammenfassung bietet eine schnelle Übersicht über die wichtigsten Aspekte und Merkmale des Periodensystems, die wir im Detail betrachtet haben. Diese Punkte sind essentiell für das Verständnis der chemischen Elemente und ihrer Interaktionen.
- Grundstruktur: Das Periodensystem ist in sieben Perioden (horizontale Reihen) und acht Hauptgruppen (vertikale Spalten) gegliedert. Jede Periode und Gruppe zeigt spezifische Muster in den Eigenschaften der Elemente.
- Wichtige Begriffe:
- Ordnungszahl: Gibt die Anzahl der Protonen und Elektronen eines Elements an und bestimmt seine Position im Periodensystem.
- Atomradius: Ändert sich von links nach rechts abnehmend innerhalb einer Periode und nimmt von oben nach unten innerhalb einer Gruppe zu.
- Elektronegativität: Zeigt die Fähigkeit eines Elements an, Elektronen anzuziehen. Sie nimmt innerhalb einer Periode von links nach rechts zu und innerhalb einer Gruppe von oben nach unten ab.
- Ionisierungsenergie: Die Energie, die benötigt wird, um ein Elektron von einem Atom zu entfernen. Sie steigt innerhalb einer Periode und fällt in einer Gruppe.
- Interaktive Elemente: Das Hinzufügen von interaktiven Tools, wie einem klickbaren Periodensystem und einem Elementvergleichswerkzeug, kann das Lernen und Verstehen erleichtern und das Benutzerengagement erhöhen.
- Historische Entwicklung: Wichtige Beiträge von Wissenschaftlern wie Johann Döbereiner, Dmitri Mendelejew und Lothar Meyer haben das Periodensystem geformt, wie wir es heute kennen.
Dieser Überblick soll das Verständnis des Periodensystems erleichtern und als schnelle Referenz für die wichtigsten chemischen Eigenschaften und wissenschaftlichen Erkenntnisse dienen.